1. Für welche Patienten dürfen zukünftig cannabishaltige Arzneimittel der GKV verordnet werden?
Seit dem 10. März 2017 können Ärzte cannabishaltige Arzneimittel für Patienten mit einer schwerwiegenden Erkrankung verordnen. Für GKV-Versicherte besteht damit ein gesetzlicher Anspruch.
§ 31 Abs. 6 SGB V legt hierfür als Voraussetzungen fest, dass
- eine allgemein anerkannte, dem medizinischen Standard entsprechende Leistung
a) nicht zur Verfügung steht oder
b) im Einzelfall nach der begründeten Einschätzung der behandelnden Vertragsärztin oder des behandelnden Vertragsarztes unter Abwägung der zu erwartenden Nebenwirkungen und unter Berücksichtigung des Krankheitszustandes der oder des Versicherten nicht zur Anwendung kommen kann, - eine nicht ganz entfernt liegende Aussicht auf eine spürbare positive Einwirkung auf den Krankheitsverlauf oder auf schwerwiegende Symptome besteht.
(Auszug § 31 Abs. 6 SGB V)
Welche Erkrankungen als „schwerwiegende Erkrankung“ zu bewerten sind, wird weder im Gesetzestext noch in der Gesetzesbegründung näher ausgeführt. In anderen Kontexten des SGB V wird eine Krankheit jedoch dann als schwerwiegend verstanden, wenn sie lebensbedrohlich ist oder wenn sie aufgrund der Schwere der durch sie verursachten Gesundheitsstörungen die Lebensqualität auf Dauer nachhaltig beeinträchtigt
(vgl. dazu § 34 Abs. 1 SGB V und § 35 Abs. 2 SGB V).
Eine Eingrenzung der Indikationsgebiete enthält das Gesetz in § 31 Abs. 6 SGB V nicht.
Siehe hierzu die nachfolgenden Hinweise zu Frage 6.
2. Welche Voraussetzungen müssen für eine Verordnung von cannabishaltigen Arzneimitteln erfüllt sein?
Genehmigung durch die Krankenkasse
Bei der ersten Verordnung muss zunächst von der zuständigen Krankenkasse des Versicherten eine Genehmigung eingeholt werden. Die Genehmigung ist vor Beginn der Behandlung von der Krankenkasse zu erteilen.
Hinweise der GKV, was bei der Beantragung durch den Versicherten zu berücksichtigen ist, liegen derzeit noch nicht vor (Stand: 02.05.2017).
Solange es noch keine konkretisierten Vorgaben der GKV gibt, sollte in einem formlosen Antrag auf die im Gesetzestext aufgeführten Voraussetzungen eingegangen werden, in dem
- dokumentiert werden muss, dass es sich um eine schwerwiegende Erkrankung handelt, für die
- dargelegt wird, dass eine allgemein anerkannte, dem medizinischen Standard entsprechende Leistung nicht zur Verfügung steht oder
- nach begründender Einschätzung dargelegt wird, dass im Einzelfall unter Abwägung der zu erwartenden Nebenwirkungen und unter Berücksichtigung des Krankheitszustandes des Patienten eine allgemein anerkannte, dem medizinischen Standard entsprechende Leistung nicht zur Anwendung kommen kann,
- dargelegt wird, dass durch die Verordnung von Cannabisblüten oder Extrakten oder cannabishaltigen Arzneimitteln eine nicht ganz entfernt liegende Aussicht auf eine spürbare positive Einwirkung auf den Krankheitsverlauf oder auf schwerwiegende Symptome besteht. (vgl. § 31 Abs. 6 SGB V)
Für die Verordnung der schon bislang verordnungsfähigen cannabinoidhaltigen Fertigarzneien ist eine vorherige Genehmigung nur dann erforderlich, wenn die Anwendung off-label erfolgen soll.
Sollte die Beantragung im Rahmen einer spezialisierten ambulanten Palliativversorgung gemäß § 37b SGB V erfolgen, sollte dies bei der Beantragung vermerkt werden, um die Genehmigungsfristen zu verkürzen (s. u.).
Entscheidungsfristen
Über den Antrag muss die Krankenkasse spätestens nach drei Wochen ab Antragseingang entschieden haben.
In Fällen, in denen die Krankenkasse eine gutachterliche Stellungnahme, z. B. des MDK, für erforderlich hält, verlängert sich diese Frist auf bis zu fünf Wochen nach Antragseingang.
Diese Fristen ergeben sich aus § 13 Abs. 3a SGB V:
„(3a) Die Krankenkasse hat über einen Antrag auf Leistungen zügig, spätestens bis zum Ablauf von drei Wochen nach Antragseingang oder in Fällen, in denen eine gutachtliche Stellungnahme, insbesondere des Medizinischen Dienstes der Krankenversicherung (Medizinischer Dienst), eingeholt wird, innerhalb von fünf Wochen nach Antragseingang zu entscheiden […].
Bei Patienten, die sich in einer spezialisierten ambulanten Palliativversorgung gemäß § 37b SGB V befinden, ist die Genehmigungsfrist für die Krankenkasse auf drei Tage verkürzt (§ 31 Abs. 6 Satz 3 SGB V).
Ablehnungsgründe
Das Gesetz legt zudem fest, dass die Krankenkasse eine Genehmigung „nur in begründeten Ausnahmefällen“ ablehnen darf (§ 31 Abs. 6 Satz 2 SGB V).
Teilnahme an einer Begleiterhebung
Aus § 31 Abs. 6 Satz 4 und 5 SGB V ergibt sich, dass der Versicherte an einer nicht-interventionellen Begleiterhebung teilnehmen muss.
Für den Arzt entstehen dabei besondere Pflichten (siehe hierzu Frage 3).
![]() LISTE WIRD NOCH LÄNGER! Also bitte noch nichts dazu posten!!!
LISTE WIRD NOCH LÄNGER! Also bitte noch nichts dazu posten!!! ![]()
--------------- 5. Februar 2020, 00:24 ---------------
3. Welche besonderen Pflichten bestehen für den verordnenden Arzt?
Datenübermittlungspflicht
Der verordnende Arzt ist verpflichtet, die für die Begleiterhebung erforderlichen Daten dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) in anonymisierter Form zu übermitteln (§ 31 Abs. 6 Satz 5 SGB V, § 4 Abs. 2 Cannabis-Begleiterhebungs-Verordnung – CanBV).
Der Arzt hat den Erhebungsbogen elektronisch auszufüllen und gemäß § 4 Abs. 2 CanBV an das BfArM zu übermitteln, wenn:
- nach Beginn der Therapie mit der durch die Krankenkasse nach § 31 Absatz 6 Satz 2 des Fünften Buches Sozialgesetzbuch genehmigten Leistung ein Jahr vergangen ist oder
- die Therapie mit der genehmigten Leistung vor Ablauf eines Jahres beendet wurde.
(Auszug aus § 4 Abs. 2 CanBV)
Informationspflicht gegenüber dem Patienten
Gemäß § 3 Cannabis-Begleiterhebungs-Verordnung muss der Arzt den Versicherten vor der ersten Verordnung in einem persönlichen Gespräch über die Begleiterhebung und das vom BfArM vorgesehene Verfahren der anonymisierten Datenübermittlung informieren (§ 3 Abs. 1 und Abs. 2 CanBV).
Das BfArM hat hierzu ein Informationsblatt erstellt, das dem Patienten auszuhändigen ist (§ 3 Abs. 2 CanBV):
http://www.bfarm.de/SharedDocs/Dow…icationFile&v=3)
Weitere Informationspflicht gegenüber dem Patienten
Ferner ist er verpflichtet, den Versicherten über die im Rahmen der Begleiterhebung an das Bundesinstitut für Arzneimittel und Medizinprodukte in anonymisierter Form zu übermittelnden Daten zu informieren (§ 31 Abs. 6 Satz 5 SGB V). Gemäß § 1 Cannabis-Begleiterhebungs-Verordnung (CanBV) sind folgende Daten an das BfArM zu übermitteln:
- Alter zum Zeitpunkt des Therapiebeginns und Geschlecht der oder des Versicherten,
- Diagnose gemäß dem Diagnoseschlüssel ICD-10, die die Verordnung der Leistung nach § 31 Absatz 6 Satz 1 des Fünften Buches Sozialgesetzbuch begründet, sowie alle weiteren Diagnosen gemäß dem Diagnoseschlüssel ICD-10,
- Dauer der Erkrankung oder Symptomatik, die die Verordnung der Leistung nach § 31 Absatz 6 Satz 1 des Fünften Buches Sozialgesetzbuch begründet,
- Angaben zu vorherigen Therapien, einschließlich der Beendigungsgründe wie mangelnder Therapieerfolg, unverhältnismäßige Nebenwirkungen, Kontraindikation,
- Angaben, ob eine Erlaubnis nach § 3 Absatz 2 des Betäubungsmittelgesetzes zur ärztlich begleiteten Selbsttherapie mit Cannabis vorlag und ob von dieser Erlaubnis Gebrauch gemacht wurde,
- Fachrichtung der verordnenden Vertragsärztin oder des verordnenden Vertragsarztes,
- genaue Bezeichnung der verordneten Leistung nach § 31 Absatz 6 Satz 1 des Fünften Buches Sozialgesetzbuch,
- Dosierung, einschließlich Dosisanpassungen, und Art der Anwendung der verordneten Leistung nach § 31 Absatz 6 Satz 1 des Fünften Buches Sozialgesetzbuch,
- Therapiedauer mit der verordneten Leistung nach § 31 Absatz 6 Satz 1 des Fünften Buches Sozialgesetzbuch,
- Angabe parallel verordneter Leistungen wie Arzneimittel nach Wirkstoffen oder physikalische Therapien,
- Auswirkung der Therapie auf den Krankheits- oder Symptomverlauf,
- Angaben zu Nebenwirkungen, die während der Therapie mit verordneten Leistungen nach § 31 Absatz 6 Satz 1 des Fünften Buches Sozialgesetzbuch auftraten,
- gegebenenfalls Angabe von Gründen, die zur Beendigung der Therapie geführt haben,
- Angaben zur Entwicklung der Lebensqualität der oder des Versicherten.
Ein entsprechender Erhebungsbogen, der vom BfArM elektronisch zur Verfügung gestellt wird, kann über https://www.begleiterhebung.de/aufgerufen werden (siehe auch Frage 14).
4. Von welchen Ärzten dürfen cannabishaltige Arzneimittel verordnet werden?
Hinsichtlich der zur Verordnung berechtigten Facharztgruppen sieht das Gesetz keine Einschränkungen vor.
Eine entsprechende Verordnung kann somit durch alle Vertragsärzte erfolgen.
--------------- 5. Februar 2020, 00:31 ---------------
--------------- 5. Februar 2020, 00:39 ---------------
5. Welche cannabishaltigen Arzneimittel dürfen verordnet werden?
Das sogenannte „Cannabis-Gesetz“ (Gesetz zur Änderung betäubungsmittelrechtlicher und anderer Vorschriften) umfasst die Verordnung von Cannabis in Form von getrockneten Blüten oder Extrakten in standardisierter Qualität und Arzneimittel mit den Wirkstoffen Dronabinol oder Nabilon (§ 31 Abs. 6 Satz 1 SGB V).
[1] Wirkstoff: Nabiximol (= Kombination THC-CBD),
Indikation: mittelschwere Spastik bei Erwachsenen mit MS
Weitere Informationen zu Sativex®:
http://www.cannabis-med.org/german/sativex.pdf
[2] Wirkstoff: Nabilon (=vollsynthetisches Derivat des Δ9-Tetrahydrocannabinols),
Indikation: Behandlung chemotherapiebedingter Emesis und Nausea bei Krebs-Patienten, die auf andere antiemetische Behandlungen nicht adäquat ansprechen
Weitere Informationen über Canemes®: https://www.gelbe-liste.de/produkte/canem…fachinformation
[3] Wirkstoff: synthetisch hergestelltes Dronabinol in Form von Kapseln. Da Marinol nur eine US-Zulassung zur Behandlung der Appetitlosigkeit mit Gewichtsverlust bei AIDS-Patienten und als Mittel der 2. Wahl gegen Übelkeit und Erbrechen im Zusammenhang mit einer Chemotherapie besitzt, kann es in Deutschland nur importiert werden (gemäß § 73 Abs. 3 AMG).
Bzgl. einer Kostenübernahme sollte daher zuvor mit der Krankenkasse Rücksprache gehalten werden.
Cannabis-Sorten
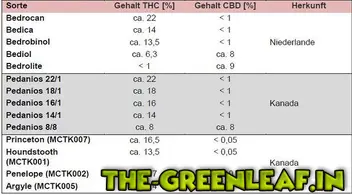
Derzeit können Cannabisblüten nur aus dem Ausland importiert werden. Mit der im Gesetz vorgesehenen Einrichtung einer Cannabisagentur (§ 19 Abs. 2a BtMG) soll innerhalb der nächsten zwei bis drei Jahre auch in Deutschland eine Produktion aufgebaut werden. Bislang sind die nachfolgend aufgeführten Cannabis-Sorten nach Deutschland importierbar:
--------------- 5. Februar 2020, 00:44 ---------------
6. Bei welchen Indikationen dürfen cannabishaltige Arzneimittel verordnet werden?
Das Gesetz macht keine Vorgaben zu den für eine Verordnung zugelassenen Indikationen.
Zu den Voraussetzungen für eine Verordnung bei einer schwerwiegenden Erkrankung siehe Frage 1 und 2.
Entwicklung einer G-BA-Richtlinie auf Grundlage der Ergebnisse der Begleiterhebung durch das BfArM
Da für viele Krankheitsbilder noch keine ausreichenden Forschungsergebnisse zum Nutzen und zur Wirkung einer Behandlung mit cannabishaltigen Arzneimitteln vorliegen, führt das BfArM über einen Zeitraum von 60 Monaten eine nicht interventionelle wissenschaftliche Begleiterhebung der von den Krankenkassen genehmigten Behandlungen durch (§ 36 Abs. 6 Satz 4 SGB V).
Mit Hilfe der anhand der Begleiterhebung gewonnenen Daten wird das BfArM einen Studienbericht erstellen, auf dessen Grundlage der Gemeinsame Bundesausschuss (G-BA) anschließend innerhalb von sechs Monaten in einer Richtlinie das Nähere zur Leistungsgewährung regeln wird (§ 36 Abs. 6 Satz 8 SGB V). Dies wird somit erst 2022 der Fall sein.
Stand der wissenschaftlichen Erkenntnisse zu relevanten Indikationsgebieten
Die CaPRiS-Studie[1] (2017), für die mehr als 2.000 Studien ausgewertet wurden, kommt hinsichtlich der Wirksamkeit, Verträglichkeit und Sicherheit von Cannabisarzneimitteln zu folgendem Ergebnis:
"Im Bereich der medizinischen Anwendung von pflanzlichen, synthetischen und teilsynthetischen Cannabinoiden wurde ein Nutzen bei der Indikation „Übelkeit und Erbrechen bzw. Appetitstimulation“ bei Menschen mit chemotherapeutisch behandelter Krebserkrankung und HIV/AIDS gefunden. Bei „chronischen Schmerzen“ liegen überwiegend Belege für eine leichte Schmerzreduktion und verschiedene Verbesserungen in Sekundärmaßen im Vergleich zum Placebo vor. Cannabisarzneimittel wurden in der Regel in Kombination mit Analgetika verabreicht. Die Daten sprechen derzeit eher nicht für eine substantielle Reduktion der Symptomatik. Bei „Spastizität bei Multipler Sklerose und Paraplegie“ liegen ebenfalls „subjektive“, jedoch nicht ausreichend objektivierbare Hinweise für eine Besserung der Symptomatik vor. Inkonsistente Ergebnisse bei meist unzureichender Studienlage liegen im Bereich der gastrointestinalen, neuroinflammatorischen, neurologischen und psychischen Erkrankungen vor. [...]"
Cannabis: Potential und Risiko. Ergebnisse einer wissenschaftlichen Analyse.Heidelberg
Nach einer Recherche der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) liegen für Cannabisarzneimittel akzeptable wissenschaftliche Erkenntnisse bislang nur für die begleitende Behandlung von Spastiken, Übelkeit und Erbrechen durch Zytostatika sowie chronische Schmerzen vor. Eine mögliche Wirksamkeit wird zudem in der Literatur für Appetitlosigkeit und Gewichtsverlust bei HIV-AIDS, Schizophrenie, Morbus Parkinson, Tourette-Syndrom, Epilepsie, Kopfschmerzen sowie chronisch entzündliche Darmerkrankungen diskutiert.
http://www.akdae.de/Stellungnahmen/Weitere/20160114.pdf
Eine von Whiting et al.[2] durchgeführte Meta-Analyse von 79 Studien zum Thema ergab eine moderate Evidenz für den Einsatz von Cannabinoiden zur Behandlung von chronischen Schmerzen und Spastiken. Eine geringere Evidenz zeigte sich für die Behandlung von Übelkeit und Erbrechen im Kontext von Chemotherapien, von Gewichtsverlust bei HIV-Infektion, von Schlafstörungen und für die Behandlung des Tourette-Syndroms.
Eine ausführliche Übersichtsarbeit[3] der US-amerikanischen National Academies of Sciences, Engineering, and Medicine stellt dar, dass eine gute Evidenz für eine therapeutische Wirksamkeit von Cannabinoiden in folgenden Indikationen vorliegt: die Behandlung chronischer Schmerzen bei Erwachsenen, von Spastik bei Multipler Sklerose und für die antiemetische Therapie von Übelkeit und Erbrechen durch Zytostatika. Mäßig oder wenig Evidenz liegt vor u. a. für die Behandlung von Schlafstörungen in bestimmten Situationen, Gewichtsverlust bei HIV/AIDS und Symptomen des Tourette-Syndroms.
Die bisherigen Ausnahmegenehmigungen für eine Behandlung mit Cannabis nach § 3 Abs. 2 BtMG (siehe hierzu Frage 15) wurde vom BfArM vorrangig bei folgenden Indikationen erteilt:
- Schmerz (ca. 57 %)
- ADHS (ca. 14 %)
- Spastik (unterschiedlicher Genese) (ca. 10 %)
- Depression (ca. 7 %)
- Inappetenz/Kachexie (ca. 5 %)
- Tourette-Syndrom (ca. 4 %)
- Darmerkrankungen (ca. 3 %)
- Epilepsie (ca. 2 %)
- Sonstige Psychiatrie (ca. 2 %)
Quelle:
Deutscher Bundestag (27.03.2017): Antwort der Bundesregierung auf die kleine Anfrage der LINKEN, Drucksache 18/11701, Cannabismedizin und Straßenverkehr, S. 3
Weitere mögliche Indikationen werden von Müller-Vahl und Grotenhermen in ihrem Artikel „Medizinisches Cannabis - Die wichtigsten Änderungen“ (DÄBl. Jg. 114 Heft 8 24. Februar 2017, A354) genannt.
Hinsichtlich der Indikationen ist darauf hinzuweisen, dass cannabinoidhaltige Arzneimittel ausschließlich symptomatisch wirken und für sie bislang keine wissenschaftlichen Erkenntnisse hinsichtlich eines therapeutischen Nutzens für die Behandlung der jeweiligen Primärerkrankung vorliegen.
Zu berücksichtigende Kontraindikationen:
Für die bislang zugelassenen cannabinoidhaltigen Fertigarzneimittel werden in den Fachinformationen folgende Kontraindikationen genannt:
Sativex®[4]:
- ist kontraindiziert bei Patienten mit einer Allergie gegen Cannabisextrakte oder gegen sonstige Bestandteile des Arzneimittels (Ethanol, Propylenglycol und Pfefferminzöl), einer bekannten oder vermuteten Anamnese oder Familienanamnese von Schizophrenie oder einer anderen psychotischen Krankheit, Anamnese von einer schweren Persönlichkeitsstörung oder einer anderen erheblichen psychiatrischen Störung mit Ausnahme von einer Depression in Folge von MS und bei Stillenden.
- Vorsicht gilt außerdem bei Kindern oder Jugendlichen unter 18 Jahren, Schwangeren, älteren Menschen, Patienten mit erheblicher Leber- oder Nierenfunktionsstörung, Patienten mit Epilepsie oder regelmäßigen Anfällen, Patienten mit schwerer Herzerkrankung wie Angina Pectoris und bei Patienten, die früher Drogen oder Suchtmittel konsumiert haben.
Canemes®[5]:
- ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegen Cannabinoide, bei Kindern oder Jugendlichen unter 18 Jahren, bei Patienten mit schweren Leberfunktionsstörungen, bei psychischen Erkrankungen einschließlich manisch-depressiver Erkrankungen und Depressionen und bei Stillenden.
- Vorsicht ist darüber hinaus bei Patienten mit Nierenfunktionsstörungen, mit Suchtmittel- oder Medikamentenmissbrauch einschließlich Alkoholmissbrauch oder Alkoholabhängigkeit, bei älteren Patienten und Patienten mit Hypertonie und Herzerkrankungen geboten.
Müller-Vahl und Grotenhermen (2017)[6] weisen auf folgende mögliche Kontraindikationen hin:
„Cannabis sollte bei Bestehen einer schweren Persönlichkeitsstörung, Psychose und schweren Herz-Kreislauf-Erkrankungen sowie Schwangeren und stillenden Müttern nicht verordnet werden. Wegen fehlender Daten sollte die Behandlung von Kindern und Jugendlichen (vor der Pubertät) sehr sorgfältig abgewogen werden. Besonders bei älteren Patienten können stärkere zentralnervöse und kardiovaskuläre Nebenwirkungen auftreten.
[1] Hoch, E., Friemel, C.M., Schneider, M. (Hrsg.). Cannabis: Potential und Risiko. Ergebnisse einer wissenschaftlichen Analyse.Heidelberg. Springer
[2] Whiting PF et al. (2015): Cannabinoids for Medical Use - A Systematic Review and Meta-analysis. In: JAMA 2015;313(24):2456-2473. doi:10.1001/jama.2015.6358
[3] National Academies of Sciences, Engineering, and Medicine (2017): The health effects of cannabis and cannabinoids: https://www.nap.edu/catalog/24625/…e-current-state
[4]https://www.gelbe-liste.de/produkte/sativ…fachinformation
[5]https://www.gelbe-liste.de/produkte/canem…fachinformation
[6] Müller-Vahl, K.; Grotenhermen, F. (2017): Medizinisches Cannabis, Die wichtigsten Änderungen, in: Dtsch Arztebl, 2017, 114(8): A 352–
--------------- 5. Februar 2020, 00:49 ---------------
7. Wie ist das BtM-Rezept bei einer Verordnung von cannabishaltigen Arzneimitteln auszufüllen?
Nach § 9 Betäubungsmittel-Verschreibungsverordnung (BtMVV) sind auf dem Betäubungsmittelrezept folgende Angaben zu machen:
- Name, Vorname, Anschrift des Patienten
- Ausstellungsdatum
- Arzneimittelbezeichnung Wenn das Arzneimittel durch diese Bezeichnung nicht eindeutig bestimmt ist, jeweils zusätzlich Bezeichnung und Gewichtsmenge des enthaltenen Betäubungsmittels je Packungseinheit, bei abgeteilten Zubereitungen je abgeteilter Form, und die Darreichungsform.
- Die Angabe „Cannabisblüten“ oder „Cannabis flos“ als Arzneimittelbezeichnung für Cannabisblüten ist nicht ausreichend, da es für die medizinische Anwendung verschiedene Sorten gibt. Daher muss die Angabe „Cannabisblüten“ durch die Sorte spezifiziert sein. Die Angabe der Sorte macht die Verschreibung eindeutig.
- Menge des verschriebenen Arzneimittels in Gramm oder Milliliter, Stückzahl der abgeteilten Form
- Gebrauchsanweisung mit Einzel- und Tagesgabe oder im Falle, dass dem Patienten eine schriftliche Gebrauchsanweisung übergeben wurde, ein Hinweis auf diese schriftliche Gebrauchsanweisung.
- Eindeutig definiert: 3x täglich 0,2 ml o. ä.
- Nicht eindeutig definiert: bei Bedarf 100 mg
- Sollte der Arzt „Gemäß schriftlicher Anweisung“ verordnen, muss die schriftliche Anweisung der Apotheke bekannt sein. Ist diese nicht bekannt, muss die Verordnung als „nicht plausibel“ in der Apotheke gewertet werden und das Rezepturarzneimittel darf nicht hergestellt werden, bis der Sachverhalt geklärt ist. Nicht plausible, also unklare Verordnungen, dürfen nicht beliefert werden. Aus Gründen der Praktikabilität empfiehlt es sich daher, die Gebrauchsanweisung auf dem Betäubungsmittelrezept zu vermerken.
- Bei Überschreitung der Höchstverschreibungsmenge der Buchstabe „A“, im Falle einer Notverschreibung der Buchstabe „N“
- Name des verschreibenden Arztes, seine Berufsbezeichnung, Anschrift einschließlich Telefonnummer
- Unterschrift des verschreibenden Arztes, im Vertretungsfall darüber hinaus der Vermerk „i. V.“
Quelle:
BAK (Hrsg.) (2017): Verordnung von Arzneimitteln mit Cannabisblüten, -extrakt und Cannabinoiden, Information für verschreibende Ärzte/innen, S. 2
Detaillierte Hinweise zum Ausfüllen des BtM-Rezeptes finden Sie hier:
BAK (Hrsg.) (2017): Verordnung von Arzneimitteln mit Cannabisblüten, -extrakt und Cannabinoiden, Information für verschreibende Ärzte/innen, S. 2-5, Stand: 02.03.2017
Vorgaben der DAC/NRF-Rezepturvorschrift
Die Art der Anwendung und die Gebrauchsanweisung kann der Arzt durch Verordnung der Nummer der DAC/NRF-Rezepturvorschrift bestimmen[1]:
- Cannabisblüten zur Inhalation nach Verdampfung (NRF 22.12.)
- Cannabisblüten in Einzeldosen zur Inhalation nach Verdampfung (NRF 22.13.)
- Cannabisblüten zur Teezubereitung (NRF 22.14.)
- Cannabisblüten in Einzeldosen zur Teezubereitung (NRF 22.15.)
- Ölige Cannabisölharz-Lösung 25 mg/ml Dronabinol (NRF 22.11.)
- Ethanolische Dronabinol-Lösung 10 mg/ml zur Inhalation (NRF 22.16.)
- Dronabinol-Kapseln 2,5 mg / 5 mg / 10 mg (NRF 22.7.)
- Ölige Dronabinol-Tropfen 25 mg/ml (NRF 22.8.)
- Ölige Cannabidiol-Lösung 50 mg/ml (NRF 22.10.)
Die individuelle Dosierung muss auf dem Rezept ergänzt werden.
Besonderheiten bei der Verordnung von Cannabisblüten
Bei medizinischer Notwendigkeit besteht im Einzelfall die Möglichkeit, auf einem Betäubungsmittelrezept auch verschiedene Cannabis-Sorten parallel zu verschreiben.[2]
Bei der Angabe der Cannabisblüten-Sorte ist deren unterschiedlicher THC/CBD-Gehalt zu berücksichtigen (siehe hierzu auch Informationen unter Frage 5).
[1] BAK (Hrsg.) (2017): Verordnung von Arzneimitteln mit Cannabisblüten, -extrakt und Cannabinoiden, Information für verschreibende Ärzte/innen, S. 3, Stand: 02.03.2017
[2] BfArM (2017): Cannabis als Medizin, Hinweise für Ärzte,
http://www.bfarm.de/DE/Bundesopium…rzte/_node.html, Zugriff: 20.03.2017
--------------- 5. Februar 2020, 00:51 ---------------
8. Welche Wirkungen sind bei einer Verordnung cannabishaltiger Arzneimittel zu erwarten?
Die Wirkung cannabinoidhaltiger Arzneimittel ist v. a. von der Zusammensetzung der in ihnen enthaltenen Cannabinoide abhängig. Insgesamt sind mehr als 85 unterschiedliche Cannabinoide mit zum Teil sehr unterschiedlichen Wirkspektren bekannt. Die vorrangig in der Hanfpflanze vorkommenden Cannabinoide sind
- Tetrahydro-Cannabinol (THC) mit v. a. antiemetischer, relaxierender, sedierender Wirkung,
- Cannabidiol (CBD) mit v. a. anti-psychotischer, anxiolytischer, anti-inflammatorischer, antiemetischer, spasmolytischer Wirkung.
Dabei kann die Wirkung des Δ9-THC durch andere Cannabinoide wie Cannabinol (CBN) oder Cannabidiol (CBD) modifiziert werden.
--------------- 5. Februar 2020, 00:54 ---------------
9. Was ist bei der Dosierung von cannabishaltigen Arzneimitteln zu beachten?
Es liegen bislang keine allgemein verbindlichen Empfehlungen zur Dosierung cannabinoid-haltiger Arzneimittel vor. Die Bundesapothekerkammer gibt folgende Dosierempfehlungen:
Bussik, D; Eckert-Lill, Ch. (2017): Cannabis als Medizin, Was kommt auf die Apotheken zu?, in: Pharmazeutische Zeitung, http://www.pharmazeutische-zeitung.de/index.php?id=67762, 08/2017, Zugriff: 19.03.2017 Müller-Vahl und Grotenhermen (2017)[1] empfehlen, alle Cannabis-basierten Medikamente und somit auch Cannabisblüten und -extrakte einschleichend zu dosieren. „Wie häufig die Einnahme pro Tag erfolgen soll, richtet sich nach der Einnahmeart, Indikation und Wirkdauer und muss individuell in Absprache zwischen Arzt und Patient ermittelt werden.“ Fertigarzneimittel: Bei den Fertigarzneimitteln Sativex®, Canemes® und Marinol®[2] sind die entsprechenden Fachinformationen zu beachten. Cannabisblüten: Die Bundesapothekerkammer (BAK) weist darauf hin, dass im unverarbeiteten Zustand Cannabisblüten schwierig zu dosieren sind. Aufgrund der unterschiedlichen Wirkstoffkonzentration in einzelnen Blütenteilen empfiehlt die BAK, dass Cannabisblüten zum Zweck der Dosiergenauigkeit vor der Abgabe durch den Apotheker zerkleinert und gesiebt werden. Zusätzlich wird empfohlen, dass die Apotheken die zerkleinerten Cannabisblüten zusammen mit einem Dosierlöffel abgeben.
[1] Müller-Vahl, K.; Grotenhermen, F. (2017): Medizinisches Cannabis, Die wichtigsten Änderungen, in: Dtsch Arztebl, 2017, 114(8): A 352–6 [2] Da Marinol nur eine US-Zulassung zur Behandlung der Appetitlosigkeit mit Gewichtsverlust bei AIDS-Patienten und als Mittel der 2. Wahl gegen Übelkeit und Erbrechen im Zusammenhang mit einer Chemotherapie besitzt, kann es in Deutschland nur importiert werden (gemäß § 73 Abs. 3 AMG). Bzgl. einer Kostenübernahme sollte daher zuvor mit der Krankenkasse Rücksprache gehalten werden.
--------------- 5. Februar 2020, 00:56 ---------------
10. Welche Einnahmearten sind möglich?
Cannabis kann im Allgemeinen inhaliert oder oral aufgenommen werden. Die Einnahmeart ist für die Dosierung zu berücksichtigen. „Welche Einnahmeart günstiger ist, hängt vom Wunsch des Patienten, der Indikation und gegebenenfalls zu berücksichtigende Begleiterkrankungen ab. In Einzelfällen kann auch eine kombinierte orale und inhalative Einnahme sinnvoll sein.“ (Müller-Vahl und Grotenhermen 2017)[1]Cannabisblüten: Die Inhaltsstoffe der Cannabisblüten können über spezielle Vaporisatoren inhaliert werden. Weniger effizient ist die Zubereitung als Tee[2]. Die Verordnung eines Vaporisators und eines Dosierlöffels ist bislang noch nicht geklärt, so dass hierfür ein entsprechender Einzelfallantrag bei der Krankenkasse gestellt werden muss. Das Verbacken in Gebäck ist laut BfArM[3] möglich, allerdings ist eine Therapie mit den Produkten schwer steuerbar, dadurch dass beim Einbacken die Dosis pro Anwendung nicht reproduziert werden kann (KBV 2017)[4]. Insofern kann diese Anwendung aus Aspekten der Arzneimitteltherapiesicherheit nicht empfohlen werden. Die Inhalation nach Verbrennung als Joint kann wegen möglicher Gesundheitsschäden nicht empfohlen werden (vgl. BfArM 2017). Cannabisextrakte: Cannabisextrakte stehen zur oralen Anwendung zur Verfügung.
- Die Ölige Cannabisölharz-Lösung 25 mg/ml Dronabinol NRF 22.11. ist peroral einzunehmen und sollte nicht verdampft und inhaliert werden.
Zubereitungen von Dronabinol: Zubereitungen von Dronabinol können als Ethanolische Dronabinol-Lösung 10 mg/ml (NRF 22.16.) inhaliert werden, oder sind peroral als Dronabinol-Kapseln 2,5 mg / 5 mg / 10 mg (NRF 22.7.) und Ölige Dronabinol-Tropfen 25 mg/ml (NRF 22.8.) einzunehmen.
[1] Müller-Vahl, K.; Grotenhermen, F. (2017): Medizinisches Cannabis, Die wichtigsten Änderungen, in: Dtsch Arztebl, 2017, 114(8): A 352–6 [2] Die KBV (KBV (Hrsg.) (2017): Informationen an die Pharmakotherapieberater der KVen, S. 7, Stand 09.03.2017) weist darauf hin, dass durch die schlechte Wasserlöslichkeit der Cannabinoide und der bei 100°C nur langsam verlaufenden Decarboxylierung (und damit Überführung in die pharmakologisch wirksame Form) die Ausbeute an THC nur ca. 5 %. beträgt. [3] BfArM (2017): Cannabis als Medizin, Hinweise für Ärzte, http://www.bfarm.de/DE/Bundesopium…rzte/_node.html, Zugriff: 20.03.2017 [4] KBV (Hrsg.) (2017): Informationen an die Pharmakotherapieberater der KVen, S. 7, Stand 09.03.2017
--------------- 5. Februar 2020, 00:58 ---------------
11. Welche Höchstmengen sind für eine Verordnung von cannabishaltigen Arzneimitteln zu beachten?
In begründeten Einzelfällen und unter Wahrung der erforderlichen Sicherheit des Betäubungsmittelverkehrs darf der Arzt für einen Patienten, der in seiner Dauerbehandlung steht, durch Kennzeichnung mit dem Buchstaben „A“ von der festgesetzten Höchstmenge abweichen (§ 2 Abs. 2 BtMVV). Für Nabilon (siehe Canemes®) wurde in der BtMVV bisher keine Höchstverschreibungsmenge festgelegt.
--------------- 5. Februar 2020, 01:01 ---------------
12. Welche möglichen Nebenwirkungen müssen bei der Verordnung beachtet werden?
Eine von Whiting et al.[1] durchgeführte Meta-Analyse von 79 Studien zum Einsatz von Cannabinoiden in der Medizin ergab ein erhöhtes Risiko für kurzzeitige unerwünschte Nebenwirkungen wie Schwindel, Mundtrockenheit, Übelkeit, Müdigkeit, Schlafstörungen, Euphorie, Erbrechen, Orientierungsstörungen, Benommenheit, Verwirrtheit, Gleichgewichtsstörungen und Halluzinationen.
Müller-Vahl und Grotenhermen (2017)[2] weisen darauf hin, dass akute Nebenwirkungen vor allem die Psyche und Psychomotorik (Euphorie, Angst, Müdigkeit, reduzierte psychomotorische Leistungsfähigkeit) sowie Herz und Kreislauf (Tachykardie, Blutdruckabfall, Schwindel, Synkope) betreffen können.
Bei den Fertigarzneimitteln Sativex®, Canemes® und Marinol® sind die entsprechenden Fachinformationen zu beachten. Zu Sativex®[3]https://www.bundesaerztekammer.de/typo3/#_ftn3 Am häufigsten (>1/10) treten Schwindel und Müdigkeit auf. Laut Fachinformation ist die Entwicklung einer Abhängigkeit von Sativex unwahrscheinlich. Häufig (>1/100, <1/10) sind:
- Depression oder Verwirrung
- Übererregtheit oder Realitätsverlust
- Gedächtnisstörungen oder Konzentrationsschwäche
- Schläfrigkeit oder Schwindel
- Seheintrübung
- Sprachstörungen
- Größerer oder kleinerer Appetit
- Veränderter Geschmackssinn oder Mundtrockenheit
- Verstopfung oder Durchfall
- Übelkeit oder Erbrechen
- Mundbeschwerden einschließlich Brennen, Schmerzen oder Mundaphthen
- Energielosigkeit oder Schwächegefühl oder allgemeines Unwohlsein
- Unbehagen oder Trunkenheitsgefühl
- Gleichgewichtsverlust oder Gefahr des Hinfallens
Zu einer additiven Wirkung kann es kommen, wenn Sativex zusammen mit Hypnotika, Sedativa oder Arzneimitteln, die sedierende (Neben-)Wirkungen entfalten, verwendet wird.
Gemäß Fachinformation sollte auf Alkohol während der Dauer der Therapie mit Sativex verzichtet werden.
Dies gilt in besonderem Maße für den Beginn der Therapie und bei Dosisänderungen.
Zu Canemes®[4]https://www.bundesaerztekammer.de/typo3/#_ftn4 Nabilon ist – bei therapeutischen Dosierungen – potentiell ein Suchtmittel mit möglichen subjektiven Nebenwirkungen. Verschreibungen sollten sich daher auf die notwendige Dauer (einige Tage) während der Chemotherapie beschränken. Das physische Abhängigkeitspotential von Nabilon ist unbekannt. Häufig (>1/100, <1/10) sind:
- Somnolenz, Ataxie, Konzentrationsschwierigkeiten, Kopfschmerzen
- Euphorie, Schlafstörungen, Dysphorie
- Sehstörungen
- Vertigo
- Hypotonie
- Mundtrockenheit, Nausea
Canemes® hat eine additive, ZNS hemmende Wirkung bei gleichzeitiger Gabe mit Diazepam, Na-Secobarbital, Alkohol oder Codein. Bei gleichzeitiger Verabreichung von Cannabinoiden wurden Wechselwirkungen mit folgenden Substanzen beobachtet: Amphetamine, Kokain, andere Sympathomimetika, Atropin, Scopolamin, Antihistaminika, andere Anticholinergika, Amitriptylin, Amoxapin, Desipramin, andere trizyklische Antidepressiva, Barbiturate, Benzodiazepine, Lithium, Opioide, Buspiron, Muskelrelaxanzien, ZNS hemmende Substanzen, Disulfiram, Fluoxetin , Antipyrine, Theophyllin , Naltrexon
--------------- 5. Februar 2020, 01:03 ---------------
13. Worüber muss der Patient vom Arzt aufgeklärt werden?
Der Patient sollte neben der üblichen Aufklärung vor Behandlungsbeginn über folgende Punkte aufgeklärt werden:
- Aufklärung über mögliche Wirkungen und Nebenwirkungen der verordneten Cannabis-Arzneimittel (siehe auch Frage 7 und 11),
- Mögliche Wechselwirkungen von Cannabis-Arzneimitteln mit anderen Arzneimitteln,
- Aufklärung über mögliche Auswirkungen auf die Verkehrstüchtigkeit,
- Hinweise zur Dosierung und Anwendungsart (siehe Fragen 9 und 10),
- Hinweise zur Lagerung, Beachtung einer kindersicheren Lagerung.
Aufklärung zur Verkehrstüchtigkeit nach Einnahme von Cannabis-Arzneimitteln
Hinsichtlich der Beurteilung der Verkehrstauglichkeit von Patienten, die ärztlich verordnete cannabishaltige Arzneimittel einnehmen, ist die Rechtslage derzeit noch unklar. Grundsätzlich sind die Begutachtungsleitlinien zur Kraftfahreignung der Bundesanstalt für Straßenwesen zu beachten. In diesen heißt es: „Wer regelmäßig (täglich oder gewohnheitsmäßig) Cannabis konsumiert, ist in der Regel nicht in der Lage, den gestellten Anforderungen zum Führen von Kraftfahrzeugen beider Gruppen gerecht zu werden. Ausnahmen sind nur in seltenen Fällen möglich, wenn eine hohe Wahrscheinlichkeit gegeben ist, dass Konsum und Fahren getrennt werden und wenn keine Leistungsmängel vorliegen."[1] Laut BfArM liegen hinsichtlich der Einnahme von Cannabis-Arzneimitteln keine ausreichend verlässlichen wissenschaftlichen Informationen vor, ob durch sie die Fähigkeit zum Führen von Kraftfahrzeugen eingeschränkt ist. Insbesondere zu Beginn der Therapie sowie in der Eindosierungsphase sei aber von einer aktiven Teilnahme am Straßenverkehr abzuraten. Ob bei stabiler Dosierung die Teilnahme am Straßenverkehr möglich ist, solle in jedem Einzelfall nach Rücksprache mit den Patientinnen und Patienten entschieden werden (BfArM 2017)[2]. In einer Antwort der Bundesregierung auf eine kleine Anfrage der LINKEN[3] heißt es hingegen: „Den Cannabispatientinnen und -patienten droht keine Sanktionierung gemäß des § 24a Absatz 2 des Straßenverkehrsgesetzes (StVG), wenn Cannabis aus der bestimmungsgemäßen Einnahme eines für einen konkreten Krankheitsfall verschriebenen Arzneimittels herrührt.“ Die Bundesregierung weist aber auch darauf hin, dass Anwendung und Vollzug dieser Vorschrift in der Hoheit der Länder liegen. Das Bundesministerium für Verkehr und digitale Infrastruktur stehe derzeit im Dialog mit den Bundesländern, um einen einheitlichen Vollzug zu gewährleisten[4]. In ihrer Antwort auf die Anfrage der LINKEN stellt die Bundesregierung zudem fest, dass nicht gesetzlich festgelegt sei, dass Patienten unter Dauermedikation einen Nachweis mitführen müssen. Allerdings empfiehlt sie Cannabispatienten, beim Führen eines Fahrzeugs eine zusätzliche Ausfertigung des Betäubungsmittelrezeptes oder eine Bescheinigung des Arztes mitzuführen. Informationspflichten des Arztes im Rahmen einer Verordnung von cannabinoidhaltigen Medikamenten: Neben der Aufklärung bestehen folgende Informationspflichten: Information über die Begleiterhebung Gemäß § 3 Cannabis-Begleiterhebungs-Verordnung muss der Vertragsarzt den Versicherten vor der ersten Verordnung über die Begleiterhebung informieren. Die Information muss gemäß § 3 Abs. 2 CanV im persönlichen Gespräch erfolgen.
Das BfArM hat hierzu ein Informationsblatt erstellt, das dem Patienten auszuhändigen ist:
http://www.bfarm.de/SharedDocs/Downloads/DE/Bundesopiumstelle/Cannabi/Infoblatt_Patienten.pdf?__blob=publicationFile&v=3)
Information über die erforderliche anonymisierte Datenübermittlung an das BfArM Daneben hat er über die erforderliche anonymisierte Datenübermittlung, einschließlich des Umfanges der zu übermittelnden Daten, an das BfArM im Rahmen der Begleiterhebung – auf der Basis des hierzu vom BfArM erstellten Informationsblattes zu informieren (s. hierzu Frage 3).Information über die erforderliche Genehmigung durch die zuständige Krankenkasse Der Arzt sollte den Patienten zudem über das erforderliche Genehmigungsverfahren bei der zuständen Krankenkasse informieren: Das Gesetz verlangt vor der Ausstellung der Verordnung eine Genehmigung durch die zuständige Krankenkasse, die vom Versicherten zu beantragen ist (s. auch Frage 2). Da derzeit (Stand: 02.05.2017) noch keine näheren Informationen darüber vorliegen, welche Angaben gegenüber der Krankenkasse im Rahmen der Antragstellung gemacht werden müssen, kann dieser auch formlos gestellt werden und sollte hierbei auf die Kriterien des Gesetzgebers gemäß § 31 Abs. 6 SGB V Bezug nehmen. Auf eine vorgesehene Verordnung im Rahmen einer spezialisierten ambulanten Palliativversorgung sollte bei der Antragsstellung aufgrund der sich damit verkürzenden Genehmigungsfristen hingewiesen werden Weitere Informationen zu den Genehmigungsfristen finden Sie unter Frage 2.
--------------- 5. Februar 2020, 01:05 ---------------
14. Welche Daten müssen vom verordnenden Arzt im Rahmen der Begleiterhebung an das BfArM übermittelt werden?
Im Rahmen der Begleiterhebung müssen Ärzte ein Jahr nach der Genehmigung der entsprechenden Therapie durch die gesetzliche Krankenkasse bzw. nach vorheriger Beendigung der Therapie definierte Behandlungsdaten in anonymisierter Form an das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) übermitteln. Für die Übermittlung der Daten zur Begleiterhebung hat das BfArM ein Onlineportal eingerichtet: https://www.begleiterhebung.de/ Den Umfang der zu erhebenden und zu übermittelnden Daten und den genauen Ablauf der Begleiterhebung regelt die zugehörige Rechtsverordnung des Bundesgesundheitsministeriums (Cannabis-Begleiterhebungs-Verordnung - CanBV). Nach dieser sind dem BfArM folgende Daten zu übermitteln (§ 1 CanBV):
- Alter zum Zeitpunkt des Therapiebeginns und Geschlecht der oder des Versicherten,
- Diagnose gemäß dem Diagnoseschlüssel ICD-10, die die Verordnung der Leistung nach § 31 Absatz 6 Satz 1 des Fünften Buches Sozialgesetzbuch begründet, sowie alle weiteren Diagnosen gemäß dem Diagnoseschlüssel ICD-10,
- Dauer der Erkrankung oder Symptomatik, die die Verordnung der Leistung nach § 31 Absatz 6 Satz 1 des Fünften Buches Sozialgesetzbuch begründet,
- Angaben zu vorherigen Therapien, einschließlich der Beendigungsgründe wie mangelnder Therapieerfolg, unverhältnismäßige Nebenwirkungen, Kontraindikation,
- Angaben, ob eine Erlaubnis nach § 3 Absatz 2 des Betäubungsmittelgesetzes zur ärztlich begleiteten Selbsttherapie mit Cannabis vorlag und ob von dieser Erlaubnis Gebrauch gemacht wurde,
- Fachrichtung der verordnenden Vertragsärztin oder des verordnenden Vertragsarztes,
- genaue Bezeichnung der verordneten Leistung nach § 31 Absatz 6 Satz 1 des Fünften Buches Sozialgesetzbuch,
- Dosierung, einschließlich Dosisanpassungen, und Art der Anwendung der verordneten Leistung nach § 31 Absatz 6 Satz 1 des Fünften Buches Sozialgesetzbuch,
- Therapiedauer mit der verordneten Leistung nach § 31 Absatz 6 Satz 1 des Fünften Buches Sozialgesetzbuch,
- Angabe parallel verordneter Leistungen wie Arzneimittel nach Wirkstoffen oder physikalische Therapien,
- Auswirkung der Therapie auf den Krankheits- oder Symptomverlauf,
- Angaben zu Nebenwirkungen, die während der Therapie mit verordneten Leistungen nach § 31 Absatz 6 Satz 1 des Fünften Buches Sozialgesetzbuch auftraten,
- gegebenenfalls Angabe von Gründen, die zur Beendigung der Therapie geführt haben,
- Angaben zur Entwicklung der Lebensqualität der oder des Versicherten.
Ein Wechsel des Arzneimittels (z. B. von Cannabisblüten hin zu Dronabinol) gilt als neue Therapie, für die erneut ein Datenerhebungssatz auszufüllen und an das BfArM zu übermitteln ist (§ 4 Abs. 3 CanBV). Für eine Änderung der Dosierung oder der Cannabisblütenart trifft dies hingegen nicht zu. Das BfArM wird nach Abschluss der Begleiterhebung einen Studienbericht erstellen, auf dessen Grundlage der Gemeinsame Bundesausschuss anschließend in einer Richtlinie das Nähere zur Leistungsgewährung regeln wird.
--------------- 5. Februar 2020, 01:06 ---------------
15. Was geschieht mit den bestehenden Ausnahmegenehmigungen für Patienten, die durch das BfArM gemäß § 3 Abs. 2 BtMG erteilt wurden?
Mit dem am 10.03.2017 in Kraft getretenen sog. „Cannabis-Gesetz“ (Gesetz zur Änderung betäubungsmittelrechtlicher und anderer Vorschriften) entfällt das bisherige Erlaubnisverfahren nach § 3 Abs. 2 BtMG. Die vom BfArM erteilte Ausnahmeerlaubnis behält nach dem Inkrafttreten des Änderungsgesetzes aber nach Angaben des BfArM noch drei Monate ihre Gültigkeit.
Weitere Informationen erhalten Sie hier: http://www.bfarm.de/DE/Bundesopium…nten/_node.html
--------------- 5. Februar 2020, 01:09 ---------------
16. Wo finde ich weiterführende Informationen?
ABDA
https://www.abda.de/service/termin…l-mit-cannabis/ AkdÄ
Cannabinoide in der Medizin (2015) http://www.akdae.de/Stellungnahmen/Weitere/20160114.pdf Apothekenkammer
http://www.pharmazeutische-zeitung.de/index.php?id=68014 BfArM
Information für Ärzte:
http://www.bfarm.de/DE/Bundesopium…rzte/_node.html Begleiterhebung:
http://www.bfarm.de/DE/Bundesopium…bung/_node.htmlhttps://www.begleiterhebung.de/ BMG
http://www.bundesgesundheitsministerium.de/service/begrif…ls-medizin.html
Deutsches Ärzteblatt
Müller-Vahl K; Grotenhermen F( 2017): Dtsch Ärztebl 2017; 114(8): A 352-6
https://www.aerzteblatt.de/archiv/186476/…ten-Aenderungen Cremer-Schaeffer P; Sudhop Th.; Broich K (2017): Dtsch Ärztebl 2017; 114(14): A677
https://www.aerzteblatt.de/treffer?mode=s…187692&s=Cremer Drogenbeauftragte der Bundesregierung
http://www.drogenbeauftragte.de/themen/drogenp…ls-medizin.html KBV
http://www.kbv.de/html/cannabis-verordnen.phGesetz zur Änderung betäubungsmittelrechtlicher und anderer Vorschriften
(„Cannabis als Medizin“):Bundesgesetzblatt 2017 Teil I Nr. 11 vom 09.03.2017, S. 403 ff.Verordnung über die Begleiterhebung nach § 31 Absatz 6 des Fünften Buches Sozialgesetzbuch (Cannabis-Begleiterhebungs-Verordnung – CanBV):Bundesgesetzblatt 2017 Teil I Nr. 14 vom 29.03.2017, S. 520 f.
Quelle : Bundesärztekammer[/b]